Состав
-
Гиалуронат натрия - 1%,
-
фосфатно-солевой буфер до 100%.
-
Состав фосфатно-солевого буфера:
-
натрия хлорид - 0,9%,
-
гидрофосфат калия - 0,028±0,003%,
-
вода инъекционная до 100%.
Содержание компонентов в 1 мл изделия
- Гиалуронат натрия - 10 мг,
- натрия хлорид - 9 мг,
- гидрофосфат калия - 0,28 ± 0,03 мг,
- вода инъекционная до 1 мл.
Основные технические и функциональные характеристики изделия
Молекулярная масса, МДа: 2,0-2,3;
Плотность, г/см3: 1,015 ± 0,01;
Содержание сухого остатка, %: 1,9 ± 0,5;
Значение рН от 7,2 до 8,0;
Осмоляльность, мОсм/кг: 240-350;
Динамическая вязкость, Па*с, при +25°С скорость сдвига от 0,01 до 2,5 с-1: 9-29;
Модуль упругости, Па: 42 - 55;
Модуль вязкости, Па: 27 - 37;
Диапазон усилия нажатия на шток шприца, необходимого для извлечения геля, при использовании рекомендуемых игл: 19G, x2" (1,1x50 мм), 20Gx1½" (0,9х40 мм), 20Gx2" (0,9х50 мм), 20Gx2¾" (0,9х70 мм), 20Gx4¾" (0,9х120 мм), 21Gx1½" (0,8x40мм), 21Gx2" (0,8x50мм), 21Gx4¾" (0,8x120мм): 4-8 Н;
Номинальный объем шприца, мл 1,0 2,25 3,0
Извлекаемый объем средства для соответствующих вариантов исполнения, мл 1,0±0,1 2,0±0,2 2,0±0,2
Видимые частицы: отсутствие видимых частиц;
Размер и количество невидимых частиц: ≥10 мкм - не более 25 000 шт./мл, ≥25 мкм субвидимые частицы - не более 5 000 шт./мл
Содержание белка < 0.1%;
Остаточное содержание эндотоксинов менее 0,5 ЕЭ/мл;
По биологической безопасности изделие удовлетворяет требованиям стандартов серии ГОСТ ISO 10993.
Способ получения гиалуроната натрия
Гиалуронат натрия получен путем бактериальной ферментации (CAS № 9067-32-7).
Описание
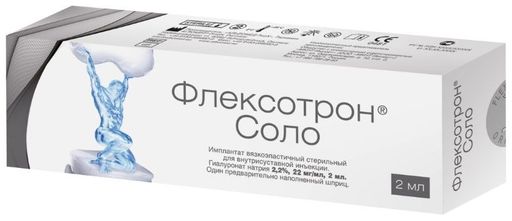
Изделие представляет собой стерильный, 1% раствор натрия гиалуроната в фосфатно-солевом буфере, вязко-эластичный, от бесцветного до светло-желтого цвета в стеклянном шприце однократного применения с соединением типа Luer-Lock™ (Луер-Лок).
Однородный раствор без запаха, без видимых частиц. Допускается наличие пузырьков в растворе. Не содержит компонентов животного происхождения.
Изделие является средством, замещающим синовиальную жидкость в полости сустава, вводится инъекционно в синовиальное пространство сустава посредством иглы инъекционной стерильной соответствующего размера.
Механизм действия и биодеградация
Гиалуроновая кислота - необходимый компонент внеклеточного матрикса, присутствует в норме в высоких концентрациях в составе синовиальной жидкости и хряща. Гиалуроновая кислота обеспечивает вязкость и эластичность синовиальной жидкости, выполняя роль внутрисуставной смазки и предотвращая трение суставных поверхностей и их преждевременное изнашивание. В составе синовиальной жидкости выступает дополнительным амортизатором (смягчает внешние удары, защищая компоненты сустава от повреждения). Также гиалуроновая кислота необходима для формирования хряща через обновление его состава. При остеоартрозе отмечаются дефицит и качественные изменения гиалуроновой кислоты в составе синовиальной жидкости и хряща.
Эффективность изделия обусловлена его биосовместимостью и физико-химическими свойствами. Механизм действия изделия основан на восстановлении вязкости синовиальной жидкости и хондропротективном действии на гиалиновый хрящ в суставах, поражённых остеоартрозом, что приводит к улучшению функционального состояния сустава. Изделие восполняет дефицит природного гиалуронана, содержащегося в синовиальной жидкости, гиалиновом хряще и других внутрисуставных структурах и утраченного в результате дегенеративных или травматических изменений тканей сустава. В результате воздействия купируется болевой синдром и улучшается подвижность сустава.
Изделие распределяется местно в полости сустава, где оно подвергается локальным преобразованиям. На основании клинических сведений об особенностях биодеградации и продолжительности эффектов внутрисуставного введения гиалуроновой кислоты предполагается, что биодеградация для каждого варианта исполнения СИНТЕСИН в организме происходит в срок от 12 до 24 недель. Скорость биодеградации зависит от состояния и особенностей метаболизма конкретного пациента. Клинический эффект сохраняется не менее 6 месяцев. Продукты деградации изделия могут быть использованы тканями в процессах повторного эндогенного синтеза гиалуронана. Выводится через гломерулярный фильтр, не повреждая почечную ткань.
Показания
-
для купирования болевого синдрома и увеличения подвижности сустава при остеоартрозе (остеоартрите) и других дегенеративно-дистрофических и посттравматических поражениях синовиальных суставов легкой и средней степени тяжести;
-
для реабилитации после перенесенных травм и ортопедической хирургии;
-
для профилактики дегенеративных изменений сустава.
-
ВНИМАНИЕ!!! Изделие предназначено только для применения квалифицированными врачами-специалистами, владеющими техникой внутрисуставной инъекции, в условиях чистой перевязочной или операционной.
Противопоказания
-
повреждения, местные инфекционные и неинфекционные (аллергические) воспалительные проявления на коже в области предполагаемого введения;
-
клинико-лабораторные признаки синовита, артрита и других проявлений воспаления инфекционного или\и неинфекционного генеза в суставе;
-
ранний период после травм или ортопедической хирургии является относительным противопоказанием - применение возможно не ранее, чем через 1 неделю после купирования воспалительного процесса;
-
патологическая кровоточивость или склонность к гиперкоагуляции;
-
диабет является относительным противопоказанием - принимая во внимание лёгкую уязвимость тканей при диабете, необходимо внимательнее относиться к использованию изделия у этой категории пациентов;
-
возраст до 18 лет (по причине отсутствия клинических данных);
-
беременность и лактация (см. ниже);
-
индивидуальная непереносимость компонентов изделия.
Применение при беременности и кормлении грудью
Влияние средства на эмбриогенез и лактацию не исследовано. Адекватные и строго контролируемые исследования у беременных и кормящих женщин не проводились. Применение при беременности и лактации не рекомендовано.
Способ применения
ВНИМАНИЕ!!! Изделие предназначено только для применения квалифицированными врачами-специалистами, владеющими техникой внутрисуставной инъекции, в условиях чистой перевязочной или операционной.
Изделие перед применением рекомендуется нагреть до комнатной температуры. При выполнении процедуры следует соблюдать правила асептики и антисептики. Изделие вводится в полость сустава при комнатной температуре, по стандартным методикам с учётом анатомических особенностей пациента - с использованием иглы размером 19G х 2˝ (1,1 х 50 мм), или 20G х 1½˝ (0,9 х 40 мм), или 20G х 2˝ (0,9 х 50 мм), или 21G х 2˝ (0,8 х 50 мм), или 21G х 1½˝ (0,8 х 40 мм) - для коленного сустава, 20G х 2¾˝ (0,9 х 70 мм), или 20G х 4¾˝ (0,9 х 120 мм), или 21G х 4¾˝ (0,8 х 120 мм) - для тазобедренного сустава или иной иглы, по усмотрению врача. Иглы 19G х 2˝ (1,1 х 50 мм), 20G х 4¾˝ (0,9 х 120 мм) и 21G х 4¾˝ (0,8 х 120 мм) не предусмотрены вариантами исполнения изделия.
В качестве рекомендуемых выше инъекционных игл, не предусмотренных вариантами исполнения изделия, а также для вариантов исполнения изделия без иглы - могут использоваться иглы соответствующего размера (рекомендуемые в данном разделе выше), зарегистрированные в установленном порядке на территории РФ. Такие иглы приобретаются дополнительно по рекомендации врача, либо используются врачом из имеющихся в наличии в медицинском учреждении.
Введение изделия в полость сустава должно быть прекращено при появлении боли во время инъекции. Введение в тазобедренный сустав рекомендуется выполнять строго под ультразвуковым или рентгеновским контролем. Навигационный контроль при введении в другие суставы желателен. В течение 2 суток (или более - по показаниям) после процедуры нагрузки на заинтересованный сустав ограничиваются.
Неиспользованное до конца изделие хранению не подлежит.
Рекомендуемая схема введения
Объем вводимого изделия за 1 процедуру зависит от размера сустава: в крупные и средние суставы вводят 2 мл, в мелкие суставы - 1 мл или менее. Курс лечения составляет от 3 до 5 инъекций с интервалом в одну неделю между введениями.
Методика введения и доза определяется индивидуально врачом и зависит от размера и особенностей сустава, стадии остеоартроза, достигнутого клинического эффекта, а также наполнения полости сустава непосредственно во время инъекции. Возможно одновременное введение изделия в несколько суставов за одну процедуру. Продолжительность эффекта до 6 месяцев. Допускаются повторные курсы лечения.
Побочные действия
В редких случаях вероятны перипроцедурные или временные постпроцедурные (от 24 до 72 часов) осложнения: боль, жжение, местное или общее повышение температуры, покраснение и отечность, увеличение содержания экссудата в полости сустава, изменение конфигурации сустава, обратимое кратковременное ограничение подвижности (скованность), чувство дискомфорта или тяжести в суставе, гематомы. На усмотрение врача они могут быть купированы с помощью анальгетиков и нестероидных противовоспалительных препаратов, снижения нагрузки на поражённый сустав, местным применением льда.
Возможные побочные эффекты и осложнения, связанные со способом введения путем внутрисуставной инъекции: боль или отек в месте инъекции, ощущение распирания, жжение, артралгия, суставной выпот, синовит, асептический острый артрит; инфекционные осложнения (пиогенный артрит, прямое инфицирование сустава при инфекционных болезнях, остеомиелит, сепсис и т. д.); повреждение сосудов или нервов (внутритканевые кровоизлияния, кровотечения в полость сустава, подкожные нейропатии, медикаментозная эмболия сосудов). Некоторые из осложнений, связанных со способом введения, можно избежать путем строгого соблюдения правил асептики и техники введения.
Поскольку изделие не содержит компонентов животного происхождения, вероятность аллергической реакции очень низка, но не исключена. Возможно развитие аллергических (зуд, сыпь, крапивница) и анафилактических реакций.
Пациенту рекомендуется проконсультироваться с врачом при появлении местных или общих симптомов, даже если они длятся до 72 часов после инъекции.
О нежелательных реакциях следует сообщать представителю Филиала Бионолтра АО в России, тел: +7 (499) 394-51-82 e-mail: info@bionoltra.com.
Лекарственное взаимодействие
Возможно одновременное применение изделия с местными анестетиками (новокаин, лидокаин). Действие в комбинации с другими лекарственными средствами не исследовано. Взаимодействие с другими изделиями, предназначенными для восстановления вязкости синовиальной жидкости, при единовременном применении (за одну процедуру) не исследовано. Не следует применять дезинфицирующие средства, содержащие четвертичные аммониевые соединения, так как гиалуроновая кислота осаждается в их присутствии.
Предупреждение
Врач должен соблюдать правила асептики и технику внутрисуставной инъекции!
Не вводить в лимфатические, железистые и другие мягкие ткани. Недопустимо попадание изделия в кровеносные сосуды. Не смешивать в рамках одной процедуры с изделиями или препаратами, предназначенными для восстановления вязкости синовиальной жидкости.
Меры предосторожности
Процедура лечения, аналогична другим внутрисуставным инъекциям, несёт минимальный риск осложнений (артралгия, воспаление, внутреннее кровотечение при травмировании сосудов и др.).
Внимание! Перед использованием изделия необходимо проверить комплектацию, срок годности, указанный на потребительской и первичной упаковках, целостность первичной упаковки.
Внимание! Запрещено использование изделия в случаях нарушения целостности первичной упаковки и/или истекшего срока годности. В обоих случаях изделие подлежит утилизации в соответствии с СанПиН 2.1.3684-21 как медицинские отходы класса А.
Внимание! Все манипуляции с изделием необходимо производить только с использованием стерильных хирургических перчаток и стерильного хирургического инструмента!
Внимание!
Изделие инертно, не радиоактивно.
Убедиться в настоящем местоположении изделия можно с помощью МРТ или УЗИ, если оно было случайно введено вне полости сустава, в самом суставе визуализировать изделие возможно только в момент введения при навигационном контроле.
Извлечение или замена изделия не применимо, так как оно неотделимо смешивается с синовиальной жидкостью сустава. Изделие при необходимости может быть выведено путём промывания и полной эвакуации жидкости.
Информация о стерильном состоянии изделия
Изделие поставляется стерильным, готовым к применению. Стерилизовано паром. Условия стерилизации: температура: 121+3 °C; давление: 210±10 кПа; длительность - 30 минут. Стерильность гарантируется только при отсутствии повреждений. Если упаковка повреждена, не использовать. Изделия стерилизованы согласно европейскому стандарту EN ISO 17665:1. Не подлежит повторной стерилизации.
Стерильность
Изделие в шприце стерильно. Стерилизовано паром. Стерильность гарантируется только при отсутствии повреждений упаковки. ЕСЛИ УПАКОВКА ПОВРЕЖДЕНА, НЕ ИСПОЛЬЗОВАТЬ! Изделие стерилизовано согласно Европейскому стандарту EN ISO 17665:1. НЕ ПОДЛЕЖИТ ПОВТОРНОЙ СТЕРИЛИЗАЦИИ!
Условия хранения
Хранить при температуре от +2°С до +25°С.
ХРАНИТЬ В НЕДОСТУПНОМ ДЛЯ ДЕТЕЙ МЕСТЕ! ХРУПКОЕ. ОСТОРОЖНО!
Беречь от влаги.
Не подвергать воздействию солнечного света.
Не замораживать!